Wikichicos/Química/La tabla periódica de los elementos
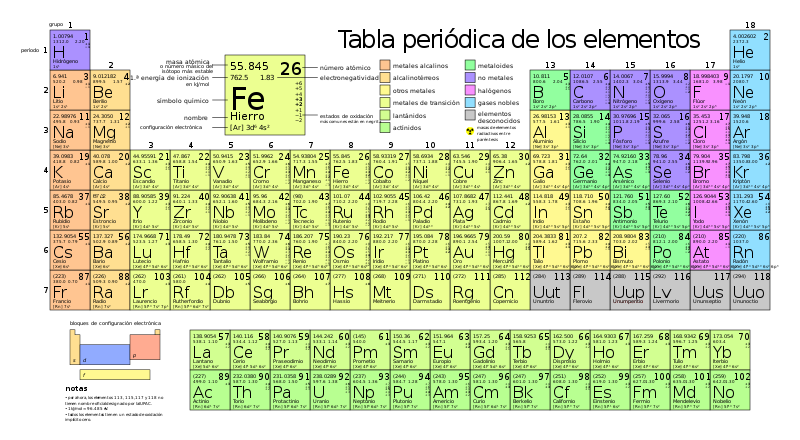
La tabla periódica de los elementos es una tabla que ordena todos los elementos químicos conocidos. Los elementos que tienen similitudes suelen colocarse cerca unos de otros.
En la tabla, los elementos se colocan en el orden de sus números atómicos empezando por el número más bajo de uno, el hidrógeno.
El número atómico de un elemento es el mismo que el número de protones en ese núcleo concreto de un átomo.
En la tabla periódica, los elementos se ordenan en períodos y grupos.
Período
editarUna fila de elementos a lo largo de la tabla se denomina período.
- Cada periodo tiene un número, del 1 al 7.
- El período 1 sólo contiene 2 elementos: hidrógeno y helio.
- Los periodos 2 y 3 tienen 8 elementos.
- Otros períodos son más largos.
- Los elementos de un período tienen números atómicos consecutivos. Los protones suelen ser iguales a los electrones.
Grupo
editarUna columna de elementos en la tabla se denomina grupo.
En la tabla periódica estándar hay 18 grupos. Cada grupo tiene un número: del 1 al 18.
Los elementos de un grupo tienen electrones dispuestos de forma similar, según el número de electrones de valencia, lo que les confiere propiedades químicas similares (se comportan de forma parecida). Por ejemplo, el grupo 18 se conoce como gases nobles porque todos son gases y no se combinan con otros átomos.
- Sistemas de numeración de los grupos
Existen dos sistemas de numeración de los grupos:
- uno con números arábigos (1,2,3)
- y otro con números romanos (I, II, III). Los nombres en números romanos se utilizaron durante la mayor parte del siglo XX.
En 1990, la Unión Internacional de Química Pura y Aplicada (IUPAC) decidió utilizar el nuevo sistema con números arábigos, en sustitución de los dos antiguos sistemas de grupos que utilizaban números romanos.
La tabla periódica ha sido utilizada por los químicos para observar patrones y relaciones entre los elementos.
- Grupos principales en la Tabla Periódica
Existen tres grupos principales en la Tabla Periódica:
- metales
- metaloides
- y no metales
Por ejemplo, los elementos situados en la parte inferior e izquierda de la tabla son los más metálicos y los situados en la parte superior derecha son los menos metálicos. (Por ejemplo, el cesio es mucho más metálico que el helio). También existen muchos otros patrones y relaciones.
La tabla periódica fue inventada por el químico ruso Dmitri Ivánovich Mendeléyev (1834-1907).
Tabla periódica estándar
editar| Grupos → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodos ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
*
Lantánidos |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
**
Actínidos |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| 8 | 119 Uue |
120 Ubn | ||||||||||||||||||
| * Serie de lantánidos | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** Serie de actínidos | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
- Series químicas de la Tabla Periódica
- Metales alcalinos
- Alcalinotérreos
- Lantánidos
- Actínidos
- Metales de transición
- Otros metales
- Metaloides
- No metales
- Halógenos
- Gases nobles
- Estado a temperatura y presión estándar. El color del número (número atómico) sobre el símbolo del elemento muestra el estado del elemento en condiciones normales.
- aquellos que están en azul son gases
- aquellos que están en verde son líquidos
- aquellos que están en negro son sólidos
- Radioactividad
- Los que tienen bordes sólidos tienen isótopos estables (Elementos primordiales)
- Los que tienen bordes discontinuos sólo tienen isótopos radiactivos naturales
- Los que tienen bordes punteados no se dan de forma natural (Elementos sintéticos)
- Los que no tienen bordes son demasiado radiactivos para haber sido descubiertos todavía.
Isótopos
editarLos átomos de un elemento químico pueden existir en diferentes tipos. Estos se llaman isótopos. Tienen el mismo número de protones (y electrones), pero diferentes números de neutrones.
Debido a que diferentes isótopos tienen diferentes números de neutrones, no todos pesan lo mismo ni tienen la misma masa.
Diferentes isótopos del mismo elemento tienen el mismo número atómico que es el número de protones.[1] Los isótopos tienen diferentes números de masa o masa atómica, sin embargo, porque tienen diferentes números de neutrones.
La palabra isótopo, que significa en el mismo lugar, proviene del hecho de que los isótopos están en el mismo lugar en la tabla periódica.
En un átomo neutro, el número de electrones es igual al número de protones. Los isótopos del mismo elemento también tienen el mismo número de electrones y la estructura electrónica. Debido a que la forma en que actúa un átomo se decide por su estructura electrónica, los isótopos son casi iguales químicamente, pero diferentes físicamente a sus átomos originales.
|
Masa atómica: La masa atómica de un elemento es la suma de la masa de sus protones y neutrones, también se conoce como número másico o peso atómico y está indicado en la tabla periódica de los elementos. En el caso del hidrógeno que está en la imagen el peso atómico es de 1.00794 |
Estabilidad
editarAlgunos isótopos son radioactivos y se llaman isótopos radioactivos. Otros no son radioactivos y se llaman isótopos estables.
El hidrógeno tiene tres isótopos comunes. (imagen)
- El isótopo más común del hidrógeno se llama protio (1H). (a la izquierda en la imagen)
- Un átomo de hidrógeno con un neutrón (número de masa 2) se llama deuterio (2H).
- El hidrógeno con un protón y dos neutrones (número de masa 3) se llama tritio (3H).[2]
El protio y el deuterio son isótopos estables, mientras que el tritio es un isótopo radioactivo.
En la naturaleza el hidrógeno está compuesto en su mayoría por protio; el deuterio se encuentra en partes muy pequeñas y el tritio es más escaso aún porque es radiactivo y se descompone rápidamente para formar otro elemento distinto, el helio.
Los elementos más pesados de la tabla periódica son todos radioactivos. Todos los isótopos del radón, torio y uranio son radioactivos, ya que son muy pesados. Esto se debe a que las fuerzas nucleares dentro del núcleo del átomo tienen dificultades para mantener juntas todas las partículas con tantos protones y neutrones en su interior.
Referencias
editar-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
editar