Química/Modelos atómicos
< Química
1.- Modelo de Demócrito:
- La materia no puede dividirse indefinidamente en partes cada vez más pequeñas, sino que está formada por partículas muy pequeñas que lo constituyen todo. A estas partículas las llamó átomos (indivisible, en griego)
- Los átomos son muy pequeños, eternos, indivisibles, homogéneos, incompresibles e invisibles. Se diferencian solo en forma y tamaño, pero no por cualidades internas.
- Las propiedades de la materia varían según el agrupamiento de los átomos.

2.- Modelo de Dalton
- El primer modelo atómico con bases científicas, formulado entre 1803 y 1807.
- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y propiedades. Los átomos de diferentes elementos tienen masas diferentes. Comparando las masas de los elementos con los del hidrógeno tomado como la unidad propuso el concepto de peso atómico relativo.
- Los átomos permanecen sin división, aun cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.

3.- Modelo de Thomson
- El átomo está compuesto por electrones de carga negativa en un átomo positivo, como un pudin de pasas.
- Los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva.
- El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos.

4.- Modelo de Rutherford
- Fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad en orbitas definidas alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
- La masa del átomo se concentra en una región pequeña de cargas positivas que impiden el paso de las partículas alfa.
- El átomo posee un núcleo o centro en el cual se concentra la masa y la carga positiva, y en la zona extranuclear se encuentran los electrones de carga negativa.

El experimento en que se basó fue mandar un haz de partículas alfa sobre una fina lámina de oro y observar cómo dicha lámina afectaba a la trayectoria de dichos rayos. Las partículas alfa se obtenían de la desintegración de una sustancia radiactiva, el polonio. Al colisionar estas partículas se desviaban en diversos ángulo, con esto se pudo calcular que el átomo está casi vacío.
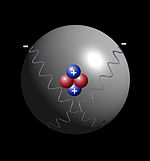
5.- Modelo de Bohr[1]
- Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.
- No todas las órbitas para los electrones están permitida, tan solo se pueden encontrar en órbitas que cumplan una serie de condiciones.
- El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles.
6.- Modelo de Planck - Schrödinger .
- Se plantea la mecánica cuántica, y en lugar de órbitas de electrones, se tiene unas regiones de espacio tiempo en la que existe una probabilidad de encontrar un electron, ésta es un Reempe (region espacio tiempo).
Notas
editarFuente
editar- Wikipedia Modelo atómico