Disolventes en la Industria Química/Hidrocarburos alifáticos
Introducción
editarLos hidrocarburos son compuestos formados por carbono e hidrógeno. Se clasifican en hidrocarburos alifáticos y aromáticos. Pueden ser moléculas cíclicas o de cadena abierta, ramificada o lineal, saturada o insaturada, siendo su nomenclatura la siguiente:
- alcanos y cicloalcanos —hidrocarburos saturados
- alquenos —hidrocarburos insaturados con uno o más dobles enlaces
- alquinos—hidrocarburos insaturados con uno o más triples enlaces
Las fórmulas generales son CnH2n+2 para los alcanos, CnH2n para los cicloalcanos, CnH2n para los alquenos, y CnH2n-2 para los alquinos.





El estado de los hidrocarburos alifáticos a temperatura ambiente depende del número de carbonos que poseen y de su estructura. Los hidrocarburos que tienen desde uno a cuatro carbonos son gaseosos (por ejemplo: metano, etano o etileno). Los hidrocarburos con más de cinco carbonos son líquidos, por ejemplo, el hexano o el octano. Y los hidrocarburos con más diecisiete carbonos son sólidos. Este es el caso del heptadecano.
Los hidrocarburos alifáticos de uso industrial derivan principalmente del petróleo, que es una mezcla compleja de hidrocarburos. Se obtienen por craqueo, destilación y fraccionamiento del petróleo crudo. Los más utilizados como disolventes son: pentano, hexano, heptano, ciclohexano y metilciclohexano. Los alquenos y alquinos se utilizan como productos de partida en síntesis química.
Propiedades físico-químicas
editar| Pentano | Hexano | Heptano | Ciclohexano | Metilciclohexano | |
|---|---|---|---|---|---|
| CAS | 109-66-0 | 110-54-3 | 142-82-5 | 110-82-7 | 108-87-2 |
| Color/forma | Líquido incoloro | Líquido incoloro | Líquido incoloro | Líquido incoloro | Líquido incoloro |
| Peso Molecular (g/mol) | 72,1 | 86,2 | 100,2 | 84,2 | 98,2 |
| Punto de ebullición (°C) | 36 | 69 | 98 | 81 | 101 |
| Punto de fusión (°C) | -129 | -95 | -90 | 7 | -126,7 |
| Densidad relativa (agua = 1) | 0,63 | 0,7 | 0,68 | 0,8 | 0,8 |
| Solubilidad en agua | Ninguna | Ninguna | Ninguna | Ninguna | Ninguna |
| Presión de vapor (kPa a 20°C) | 56,8 | 17 | 4,8 | 12,7 | 5,73 |
| Densidad relativa de vapor (aire = 1) | 2,5 | 3,0 | 3,46 | 2,9 | 3,4 |
| Punto de inflamación (°C) | -49 | -22 | -1 | -18 | -6 |
| Temperatura de autoignición (°C) | 309 | 225 | 215 | 260 | 258 |
| Límites de explosividad(% en volumen en el aire) | 1,5-7,8 | 1,1-7,5 | 1,1-6,7 | 1,3-8,8 | 1,2-6,7 |
| Coeficiente de reparto octanol/agua (log Pow) | 3,39 | 3,90 | 4,66 | 3,40 | 3,61 |
Peligrosidad
editarTodos estos hidrocarburos son altamente inflamables y las mezclas vapor/aire son explosivas.
Como medidas de prevención se deben de evitar las llamas, no producir chispas y no fumar. El pentano no debe estar en contacto con oxidantes fuertes y el ciclohexano con superficies calientes.
La clasificación de estos disolventes según la NFPA 704 aparece recogida en la siguiente tabla.[1]
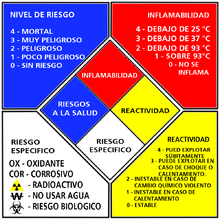
| Hidrocarburo | Riesgo a la salud | Inflamabilidad | Reactividad | Riesgo especial |
|---|---|---|---|---|
| Pentano | 3 | 4 | 0 | - |
| Hexano | 3 | 3 | 0 | - |
| Heptano | 3 | 3 | 0 | - |
| Ciclohexano | 3 | 3 | 0 | - |
| Metilciclohexano | 3 | 3 | 0 | - |
La mayoría de los incendios causados por hidrocarburos líquidos se deben a un escape de los mismos llegado a una fuente de ignición o extendiéndose y evaporándose rápidamente. Un ejemplo sería la explosión que tuvo lugar en 1974 en Flixborough (Reino Unido). Este accidente de debió a un escape unas 40 Tm de ciclohexano que formó una nube inflamable e inmediatamente se produjo una explosión de vapor no confinada al entrar en contacto con una fuente de ignición. [2] [3]
Efectos tóxicos
editarLos hidrocarburos alifáticos superiores al etano son depresores del sistema nervioso central. Los vapores producen una ligera irritación de las mucosas. Se puede decir que en general, la toxicidad de los alcanos aumenta al hacerlo el número de carbonos de la molécula. Los hidrocarburos saturados líquidos son disolventes de grasas e irritantes de la piel. El contacto repetido o prolongado con la piel, la seca y desengrasa, con resultado de irritación y dermatitis. El contacto directo de los hidrocarburos líquidos con el tejido pulmonar a través de la inhalación produce neumonitis química, edema pulmonar y hemorragia. La intoxicación crónica por hexano o mezclas que contengan hexano puede causar polineruopatía.
El hexano puede entrar en el organismo vía inhalación o a través de la piel siendo su absorción lenta. El hexano tiende a evaporarse cuando se ingiere produciéndose su rápida dilución en el aire alveolar y un descenso del oxígeno, con asfixia y lesión cerebral o parada cardíaca. El hexano tiene una toxicidad aguda tres veces superior que el pentano. Los efectos crónicos se producen por exposición prolongada a dosis que no producen síntomas agudos aparentes. Después de que aparezcan los primeros síntomas se produce el agravamiento de la deficiencia motora de las regiones afectadas en un principio y su extensión a otras. La lesión suele extenderse de los miembros inferiores a los superiores. En casos graves de intoxicación se han observado síntomas en el sistema nervioso central (defectos de la función visual o de la memoria). En la ruta metabólica del hexano, éste se transforma en 2-hexanol que a su vez se transforma en 2,5-hexanodiol y 2,5-hexanodiona. Éste último metabolito es el más tóxico.
Los cicloalcanos producir efectos tóxicos por inhalación e ingestión, tienen una acción irritante y desengrasante de la piel. Son anestésicos y depresores del sistema nervioso central.
La toxicidad aguda del ciclohexano es muy pequeña. Los vapores de ciclohexano causan un leve y corto efecto anestésico, pero más potente que el del hexano. Los experimentos con animales han demostrado que el ciclohexano es mucho menos nocivo que el benceno. El metilciclohexano tiene efectos tóxicos similares pero menos intensos que el ciclohexano.
Uso en la industria
editarEl uso de disolventes derivados de los hidrocarburos del petróleo en Europa es inferior al 10%. En España la situación es similar.[4]
Los hidrocarburos saturados se usan como combustibles, lubricantes y disolventes. También se pueden utilizar como materias primas para la síntesis de plásticos, detergentes, pesticidas o productos químicos.
El pentano es uno de los agentes espumantes primarios que se usan en la producción de espuma de poliestireno. El heptano se usa como combustible para motores o como disolvente. El hexano se usa principalmente como disolvente de gomas, colas en muebles y bolsos de cuero, cementos y adhesivos para el calzado. Se puede usar como adhesivo para papeles de pared, en la fabricación de impermeables, en el recauchutado de neumáticos y en la extracción de aceites vegetales. El hexano se utiliza también como agente limpiador en las industrias de tejidos, muebles y cuero. La mayoría del ciclohexano producido se transforma en la mezcla ciclohexanona-ciclohexanol que se utiliza para la obtención de ácido adípico y caprolactama que se utilizan para la síntesis del nylon. Sin emabrgo, el ciclohexano junto con el hexano forma la mezcla conocida como "hexano comercial" que se utiliza como disolvente en la industria del calzado.
Impacto ambiental
editarLos compuestos orgánicos volátiles, a veces llamados VOC (siglas en inglés), o COV (siglas en español), se convierten fácilmente en vapores o gases. Este término agrupa a una gran cantidad de compuestos químicos, entre los que se incluyen los hidrocarburos alifáticos. El uso de los hidrocarburos alifáticos como disolventes en la industria hace que se liberan a la atmósfera, principalmente hexano.

La liberación de COVs al aire se puede comparar con su capacidad para formar ozono en relación a etileno (factor de producción de ozono troposférico o POCP). En 2003, el POCP relacionado con emisiones de disolventes fue de 2,21 millones de kilogramos equivalentes a etileno. Los alquenos tienen un factor POCP igual a 84 y los alcanos, 42. Estos valores indican que los alcanos y especialmente los alquenos pueden formar ozono. Cuando estos compuestos se mezclan con óxidos de nitrógeno, reaccionan para formar ozono y producir el conocido smog fotoquímico.
En la siguiente gráfica se recogen las emisiones de hidrocarburos (COV) que se produjeron en 2009 en los países de la Unión Europea.[5]

Sustitución por disolventes alternativos
editarDebido a la toxicidad del hexano éste se puede sustituir por disolventes menos tóxicos como el ciclohexano, el heptano y el metilciclohexano ya que sus propiedades físicas y químicas son similares.
Además de sustituir hexano por estos disolventes, existen otras alternativas que se están estudiando en las empresas para eliminar el uso de estos disolventes.[6] Algunos ejemplos son los siguientes. En la extracción de aceites vegetales se puede utilizar dióxido de carbono en lugar de hexano. En la industria del calzado se pueden unir los adornos mediante adhesivos al agua o cinta adhesiva a dos caras en lugar de utilizar heptano. En el tapizado de muebles se puede sustituir el hexano por adhesivos al agua o grapas. En la industria papelera se utiliza hexano para pegar papel pero se podría emplear cinta adhesiva.
REFERENCIAS
editar- ↑ http://www.newenv.com/resources/nfpa_chemicals/
- ↑ http://www.aiche.org/ccps/topics/elements-process-safety/commitment-process-safety/process-safety-culture/flixborough-case-history
- ↑ http://www.unizar.es/guiar/1/Accident/Flix.htm
- ↑ http://www.magrama.gob.es/es/calidad-y-evaluacion-ambiental/temas/sistema-espanol-de-inventario-sei-/06_Uso_de_Disolventes_y_Otros_Productos_-_VNC_tcm7-219786.pdf
- ↑ http://www.esig.org/publications/194/40/esig-esvoc-coordination-group-solvent-voc-emissions-inventories-position-paper/?cntnt01currentpage=1&cntnt01limit=5&cntnt01detailpage=publications&cntnt01orderby=Date+DESC&cntnt01template=display_home_list&cntnt01origid=15
- ↑ http://www.istas.net/fittema/att/di8.htm
Bibliografía
editar- V. Aguirre Yela: "Obtención de pentanos, hexanos, heptanos y octanos a partir de las fracciones de los derivados livianos del petróleo." Escuela politécnica del ejército. Vol 14 (2011)
- Fichas Internacionales de Seguridad Química
- Monografía XII. Contaminación y Salud. Capítulo IX: Compuestos orgánicos volátiles en el medio ambiente. José María Sánchez Montero y Andrés R. Alcántara León. 2007. Monografías de la Real Academia Nacional de Farmacia