Disolventes en la Industria Química/Cetonas
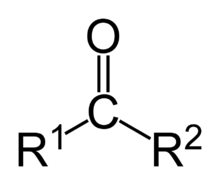
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos sustituyentes constituidos por átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno. Como disolventes, las cetonas son clasificadas como disolventes polares apróticos. La polaridad del grupo carbonilo también las convierte en aceptoras de puentes de hidrógeno, pero no en donoras, lo que impide la "asociación" de las moléculas. Esto supone una mayor volatilidad de las cetonas respecto a alcoholes o ácidos carboxílicos de peso molecular comparable, que aunque lógicamente implica una solubilidad en agua menor, explica la perseverancia en su uso como disolventes y en perfumería. También se usan como precursores poliméricos y en la industria farmacéutica. Las cetonas más ampliamente utilizadas son la acetona, la metil etil cetona y la ciclohexanona.
Acetona
editarLa acetona o propanona es el compuesto orgánico de fórmula molecular (CH3)2CO, y la más simple de las cetonas. A temperatura ambiente, se trata de un líquido incoloro de olor característico, volátil e inflamable. Se obtiene a escala industrial mediante hidrólisis catalítica en medio ácido del hidroperóxido de isopropilbenceno (que se obtiene mediante la alquilación de benceno con propileno, seguida por un proceso de oxidación), que permite también la obtención de fenol (ruta del cumeno).
Otras posibles vías son:
- Deshidrogenación catalítica de isopropanol
- Fermentación
- Oxidación de propileno (proceso Hoechst-Wacker), polipropileno y diisopropilbenceno.
Algunas de sus propiedades físico-químicas son las siguientes:
- Punto de ebullición: 329.3 K (56ºC)
- Punto de fusión: 178.7 K (-94ºC)
- Punto de inflamación: 255.15 K (-18ºC)
- Temperatura de autoignición: 738.15 K (465ºC)
- Solubilidad en agua: soluble
- Densidad: 0.8 g/cm3
- Coeficiente de reparto octanol/agua: log Pow = -0.24
La acetona como disolvente supone el 17% de la producción total, el resto se destina para la producción de MMA (metil metacrilato) y PMMA (polimetilmetacrilato) usados en construcción (42%), Bisfenol-A para automóviles y microelectrónica (24%), derivados del aldol (13%), y otros (4%).
En cuanto a la peligrosidad, su punto de inflamación está en 255 K (-18ºC), y su temperatura de autoignición en 738 K (465ºC), por lo que se trata de un líquido extremadamente inflamable, aunque es difícil alcanzar la temperatura para que arda espontáneamente, muy parecido al MTBE. Se trata de un compuesto que produce irritación respiratoria al ser inhalado, pudiendo llegar a la pérdida de conocimiento, y también irrita la piel y los ojos. Su ingestión puede producir náuseas y vómitos.
Metil Etil Cetona
editarLa metil etil cetona, también conocida como butanona o MEC, tiene una fórmula molecular de C4H8O. A temperatura ambiente, se presenta en forma de líquido incoloro inflamable, de olor característico, dulzón y penetrante. Existen dos procesos fundamentales para su obtención: el primero consiste en la deshidrogenación catalítica del alcohol sec-butílico a 250-330ºC, en presencia de cobre, zinc o bronce. El segundo proceso, denominado proceso Hoechst-Wacker, se trata de una oxidación con aire del 1-buteno en presencia de una disolución acuosa de cloruros metálicos.
Algunas de sus características principales son:
- Punto de ebullición:353 K (80ºC)
- Punto de fusión: 186.5 K (-86ºC)
- Punto de inflamación: 264.15 K (-9ºC)
- Temperatura de autoignición: 778.15 K (505ºC)
- Solubilidad en agua: 27-29g/100mL de agua (20ºC)
- Densidad: 0.805 g/cm3
- Coeficiente de reparto octanol/agua: log Pow = 0.29
Su aplicación principal es como disolvente universal de nitro- y acetilcelulosas, resinas vinílicas, cauchos clorados y celuloides, en la industria de lacas y pegamentos; así como para la desparafinación de los aceites pesados.
En cuanto a la peligrosidad, su punto de inflamación está en 264K (-9ºC), y su temperatura de autoignición en 778K (505ºC), por lo que se trata de un líquido extremadamente inflamable, aunque es más difícil alcanzar la temperatura para que arda espontáneamente, también muy parecido al MTBE. Los efectos tóxicos son similares a los provocados por la acetona.
Metil Isobutil Cetona
editarLa metil isobutil cetona, también conocida como MIBK, es un líquido incoloro que tiene una fórmula molecular de C6H12O. Se obtienen millones de kilogramos a partir de acetona mediante tres reacciones: una condensación aldólica, para dar un alcohol diacetona; una deshidratación, para dar un óxido de mesitilo y por último una reacción con hidrógeno en presencia de Pd para dar MIBK:
Algunas de sus características principales son:
- Punto de ebullición: 390 K (117ºC)
- Punto de fusión: 187.8 K (-84.7ºC)
- Punto de inflamación: 290.15 K (17ºC)
- Temperatura de autoignición: 732.15 K (459ºC)
- Solubilidad en agua: 1.91g/100mL de agua (20ºC)
- Densidad: 0.802 g/cm3
- Viscosidad: 0.58 cP (20ºC)
Se emplea para el desparafinado de aceites lubricantes, como base o componentes de pinturas, esmaltes, lacas, barnices, selladores, diluyentes, etc. También es común su uso como tensioactivo de tintas, pinturas y pesticidas. Otros usos serían las extracciones líquido/líquido o sólido/líquido.
En cuanto a la peligrosidad, su punto de inflamación está en 290K (17ºC), y su temperatura de autoignición en 732K (459ºC), por lo que se trata de un líquido no muy inflamable, siendo difícil alcanzar la temperatura para que arda espontáneamente. Los vapores causan irritación de las vías respiratorias y los ojos teniendo como efecto bronquitis, deshidratación y efectos sobre el sistema nervioso central.
Ciclohexanona
editarLa ciclohexanona, molécula cíclica compuesta de seis átomos de carbono y con un grupo funcional cetona, pertenece al grupo de las cetonas cíclicas, y se trata de un líquido incoloro, cuyo olor recuerda al de la acetona. La síntesis industrial de la ciclohexanona tiene lugar principalmente a través de dos procesos:
- Oxidación catalítica de ciclohexano con oxígeno atmosférico, que transcurre a través de un hidroperoxiciclohexano (o hidroperóxido de ciclohexilo) inestable, el cual vía un mecanismo radicalario da lugar a una mezca de ciclohexanona y ciclohexanol. La mezcla a continuación se separa por destilación, y el ciclohexanol aislado puede seguidamente oxidarse a más ciclohexanona.
Algunas de sus propiedades físico-químicas son las siguientes:
- Punto de ebullición: 428.8 K (155.6ºC)
- Punto de fusión: 242.15 K (-31ºC)
- Punto de inflamación: 317.15 K (44ºC)
- Temperatura de autoignición: 697.15 K (420ºC)
- Solubilidad en agua: 8.7g/100mL de agua (20ºC)
- Densidad: 0.9478 g/cm3
- Coeficiente de reparto octanol/agua: log Pow = 0.81
La ciclohexanona se emplea como disolvente en la industria, y como reactivo en la producción de ácido adípico y de caprolactama, compuestos empleados en la fabricación de nylon-6,6 y nylon-6 respectivamente. También es usado en la fabricación de PVC y como pegamento para unir partes o trozos de PVC y nylon-6,6.
En cuanto a la peligrosidad, su punto de inflamación está en 317K (44ºC), y su temperatura de autoignición en 697K (420ºC), por lo que se trata de un líquido no muy inflamable, siendo difícil alcanzar la temperatura para que arda espontáneamente. Los vapores causan irritación de las vías respiratorias y los ojos teniendo como efecto bronquitis, deshidratación y efectos sobre el sistema nervioso central.
REFERENCIAS
editar- Martínez Grau, M.ª Ángeles, G. Csákÿ, Aurelio (2001). «3». Técnicas experimentales en síntesis orgánica. España: SÍNTESIS. ISBN 84-7738-605-6.